filmov
tv
Tabela Periódica | Introdução | Aula 01

Показать описание
Bora falar da tabela periódica?
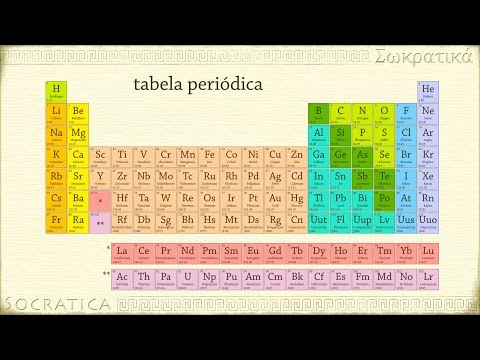
A tabela periódica é uma ferramenta fundamental nos estudos da química e sendo assim é importante saber as principais informações que ela apresenta.
Você sabe quantas linhas e colunas a tabela contém?
E essas linhas e colunas, como são chamadas?
Onde estão os metais e os ametais? E os semimetais?
Saiba todas as repostas e mais assistindo a essa aula!
🔔 INSCREVA-SE NO CANAL
👍 Gostou do vídeo? Deixe seu LIKE!
Me acompanhe também pelas redes sociais:
#química #tabelaperiódica #elementosquímicos
A tabela periódica é uma ferramenta fundamental nos estudos da química e sendo assim é importante saber as principais informações que ela apresenta.
Você sabe quantas linhas e colunas a tabela contém?
E essas linhas e colunas, como são chamadas?
Onde estão os metais e os ametais? E os semimetais?
Saiba todas as repostas e mais assistindo a essa aula!
🔔 INSCREVA-SE NO CANAL
👍 Gostou do vídeo? Deixe seu LIKE!
Me acompanhe também pelas redes sociais:
#química #tabelaperiódica #elementosquímicos
Entenda a TABELA PERIÓDICA em 10 minutos - Toda Matéria
TABELA PERIÓDICA: DEFINIÇÃO, NÚMEROS E PERÍODOS | QUER QUE DESENHE?
Tabela Periódica | Introdução | Aula 01
TABELA PERIÓDICA - Início de tudo
Tabela Periódica - Brasil Escola
🧪 BLOCOS DA TABELA PERIÓDICA
INTRODUÇÃO à TABELA PERIÓDICA: Organização Elementos, Massa Atômica, Símbolos | Aula 07 (Química I)...
TABELA PERIÓDICA - AULA 01
História da Tabela Periódica - Brasil Escola
Tabela Periódica: o que é? como usar?
Tabela Periódica [Mapa Mental] [COMPLETO] - Mapas da Química
O ESSENCIAL SOBRE TABELA PERIÓDICA
Tabela - Propriedades periódicas.
Tabela Periódica
TABELA PERIÓDICA - DICA ENEM - Prof. Marcus I Bioexplica
TABELA PERIÓDICA: CLASSIFICAÇÃO DOS ELEMENTOS | MINUTO RESUMO | DESCOMPLICA
Classificação Periódica dos Elementos - Brasil Escola
Como decorar a TABELA PERIÓDICA por frases | Método mais fácil | Seja Um Estudante Melhor
A HISTÓRIA DA TABELA PERIÓDICA | FALA CIENTISTA
TABELA PERIÓDICA: o que é, elementos, famílias, períodos | RESUMO DE QUÍMICA PARA O ENCCEJA
PROPRIEDADES DA TABELA PERIÓDICA | Resumo de Química Enem. Professor Felipe Sobis
TABELA PERIÓDICA: organização dos elementos químicos | Química para o Enem | Felipe Sobis
Tabela Periódica História e Evolução
Tabela Periódica | Revisão
Комментарии
 0:09:25
0:09:25
 0:05:44
0:05:44
 0:24:11
0:24:11
 0:12:57
0:12:57
 0:09:41
0:09:41
 0:07:08
0:07:08
 0:24:58
0:24:58
 0:14:24
0:14:24
 0:07:49
0:07:49
 0:21:32
0:21:32
 0:16:37
0:16:37
 0:35:37
0:35:37
 0:14:09
0:14:09
 0:07:54
0:07:54
 0:05:44
0:05:44
 0:01:38
0:01:38
 0:07:08
0:07:08
 0:08:52
0:08:52
 0:11:05
0:11:05
 0:07:25
0:07:25
 0:09:58
0:09:58
 0:06:51
0:06:51
 0:03:31
0:03:31
 0:18:03
0:18:03