filmov
tv
Aula 1 - Distribuição eletrônica em subníveis

Показать описание
No modelo atômico de Böhr, os elétrons descrevem órbitas circulares ao redor do núcleo. Cada uma dessas órbitas tem energia constante. Os elétrons que estão situados em órbitas mais afastadas do núcleo apresentarão maior quantidade de energia.
Quando um elétron absorve certa quantidade de energia, salta para uma órbita mais energética.
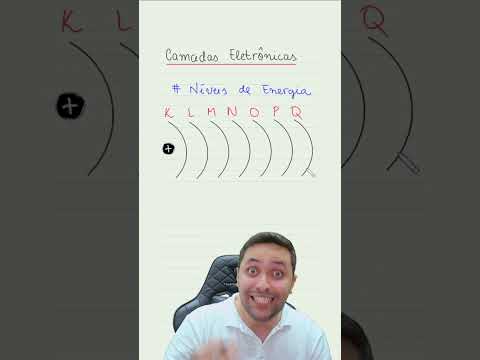
Essas órbitas foram denominadas níveis de energia. Hoje são conhecidos sete níveis de energia ou camadas, denominadas K, L, M, N, O, P e Q.
Os níveis de energia são divididos em regiões ainda menores, denominadas subníveis de energia.
O número de cada nível indica a quantidade de subníveis nele existentes. Por exemplo, o nível 1 apresenta um subnível, o nível 2 apresenta dois subníveis, e assim por diante. Os subníveis são representados pelas letras s, p, d, f, g, h, … Obs.: Os subníveis g, h, … são teóricos, não são conhecidos átomos que apresentam número de elétrons suficiente para ocupar esses subníveis.
A criação de uma representação gráfica para os subníveis facilitou a visualização da sua ordem crescente de energia. Essa representação é conhecida como diagrama de Linus Pauling.
O preenchimento da eletrosfera pelos elétrons em subníveis obedece à ordem crescente de energia definida pelo diagrama de Pauling:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Cada um desses subníveis pode acomodar um número máximo de elétrons:
s = 2e-
p = 6e-
d = 10e-
f = 14e-
Referência:
USBERCO, J.; SALVADOR, E. Química, volume único. 5. ed. São Paulo: Saraiva, 2002, parte 1, unid. 3, p. 64-7.
Quando um elétron absorve certa quantidade de energia, salta para uma órbita mais energética.
Essas órbitas foram denominadas níveis de energia. Hoje são conhecidos sete níveis de energia ou camadas, denominadas K, L, M, N, O, P e Q.
Os níveis de energia são divididos em regiões ainda menores, denominadas subníveis de energia.
O número de cada nível indica a quantidade de subníveis nele existentes. Por exemplo, o nível 1 apresenta um subnível, o nível 2 apresenta dois subníveis, e assim por diante. Os subníveis são representados pelas letras s, p, d, f, g, h, … Obs.: Os subníveis g, h, … são teóricos, não são conhecidos átomos que apresentam número de elétrons suficiente para ocupar esses subníveis.
A criação de uma representação gráfica para os subníveis facilitou a visualização da sua ordem crescente de energia. Essa representação é conhecida como diagrama de Linus Pauling.
O preenchimento da eletrosfera pelos elétrons em subníveis obedece à ordem crescente de energia definida pelo diagrama de Pauling:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Cada um desses subníveis pode acomodar um número máximo de elétrons:
s = 2e-
p = 6e-
d = 10e-
f = 14e-
Referência:
USBERCO, J.; SALVADOR, E. Química, volume único. 5. ed. São Paulo: Saraiva, 2002, parte 1, unid. 3, p. 64-7.
Комментарии
 0:10:07
0:10:07
 0:08:29
0:08:29
 0:13:06
0:13:06
 0:19:11
0:19:11
 0:13:14
0:13:14
 0:05:43
0:05:43
 0:12:21
0:12:21
 0:41:30
0:41:30
 0:48:05
0:48:05
 1:23:14
1:23:14
 0:06:56
0:06:56
 0:14:22
0:14:22
 0:00:53
0:00:53
 0:12:06
0:12:06
 0:05:15
0:05:15
 0:08:55
0:08:55
 0:14:24
0:14:24
 0:04:39
0:04:39
 0:45:06
0:45:06
 0:12:57
0:12:57
 2:23:20
2:23:20
 0:00:43
0:00:43
 0:12:21
0:12:21
 0:00:46
0:00:46