filmov
tv
DIAGRAMA DE FASE

Показать описание
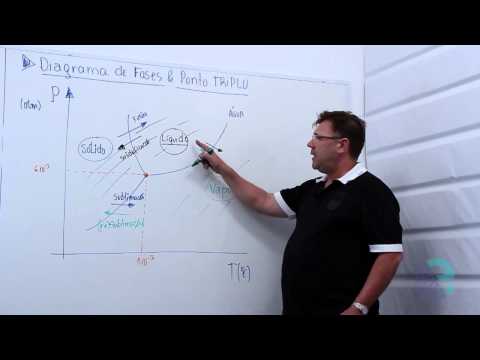
En termodinámica y ciencia de materiales se denomina diagrama de fase o diagrama de estados de la materia, a la representación entre diferentes estados de la materia, en función de variables elegidas para facilitar el estudio del mismo.1 Cuando en una de estas representaciones todas las fases corresponden a estados de agregación ,diferentes se suele denominar diagrama de cambio de estado.
Existen diferentes diagramas según los materiales, sean totalmente solubles en estado sólido y líquido, o sea miscibles, o que sean insolubles. También pueden darse casos particulares.
Uno de los diagramas de equilibrio más clásico es el de los aceros que tiene particularidades, donde afecta claramente la concentración y las diferentes cristalizaciones que pueden darse en el hierro en estado sólido y a diferentes temperaturas.
Pares (presión, temperatura) de transición de fase entre:
Dos fases sólidas: Cambio alotrópico
Entre una fase sólida y una fase líquida: fusión - solidificación
Entre una fase sólida y una fase vapor (gas): sublimación - deposición (o sublimación inversa)
Entre una fase líquida y una fase vapor: vaporización - condensación (o licuefacción)
Es importante señalar que la curva que separa las fases vapor-líquido se detiene en un punto llamado punto crítico (La densidad del líquido y vapor son iguales). Más allá de este punto, la materia se presenta como un fluido supercrítico que tiene propiedades tanto de los líquidos como de los gases. Modificando la presión y temperatura en valores alrededor del punto crítico se producen reacciones que pueden tener interés industrial, como por ejemplo las utilizadas para obtener café descafeinado.
Es preciso anotar que, en el diagrama P-T del agua, la línea que separa los estados líquido y sólido tiene pendiente negativa, lo cual es algo bastante inusual. Esto quiere decir que aumentando la presión el hielo se funde, y también que la fase sólida tiene menor densidad que la fase líquida.
Existen diferentes diagramas según los materiales, sean totalmente solubles en estado sólido y líquido, o sea miscibles, o que sean insolubles. También pueden darse casos particulares.
Uno de los diagramas de equilibrio más clásico es el de los aceros que tiene particularidades, donde afecta claramente la concentración y las diferentes cristalizaciones que pueden darse en el hierro en estado sólido y a diferentes temperaturas.
Pares (presión, temperatura) de transición de fase entre:
Dos fases sólidas: Cambio alotrópico
Entre una fase sólida y una fase líquida: fusión - solidificación
Entre una fase sólida y una fase vapor (gas): sublimación - deposición (o sublimación inversa)
Entre una fase líquida y una fase vapor: vaporización - condensación (o licuefacción)
Es importante señalar que la curva que separa las fases vapor-líquido se detiene en un punto llamado punto crítico (La densidad del líquido y vapor son iguales). Más allá de este punto, la materia se presenta como un fluido supercrítico que tiene propiedades tanto de los líquidos como de los gases. Modificando la presión y temperatura en valores alrededor del punto crítico se producen reacciones que pueden tener interés industrial, como por ejemplo las utilizadas para obtener café descafeinado.
Es preciso anotar que, en el diagrama P-T del agua, la línea que separa los estados líquido y sólido tiene pendiente negativa, lo cual es algo bastante inusual. Esto quiere decir que aumentando la presión el hielo se funde, y también que la fase sólida tiene menor densidad que la fase líquida.
Комментарии
 0:08:56
0:08:56
 0:08:40
0:08:40
 0:05:36
0:05:36
 0:06:49
0:06:49
 0:14:52
0:14:52
 0:38:58
0:38:58
 0:04:05
0:04:05
 0:16:10
0:16:10
 0:05:26
0:05:26
 0:04:54
0:04:54
 0:18:19
0:18:19
 0:44:21
0:44:21
 0:27:19
0:27:19
 0:08:18
0:08:18
 0:09:31
0:09:31
 0:09:39
0:09:39
 0:03:19
0:03:19
 0:09:13
0:09:13
 0:17:47
0:17:47
 0:05:48
0:05:48
 0:14:23
0:14:23
 0:01:26
0:01:26
 0:05:13
0:05:13
 0:08:18
0:08:18