filmov
tv
QUÍMICA Número de Avogadro

Показать описание
Primera parte de conceptos básicos de estructura atómica. Con este curso de 4 vídeos entenderéis muy bien la estructura de un átomo.
muchos saludos y espero que os guste!! ;)
muchos saludos y espero que os guste!! ;)
Química - Número de Avogadro
Número de Avogadro
¿Qué es un MOL? Número de Avogadro con Cheems y Doge
🧪 MOL, MASSA E AVOGADRO. APRENDA RÁPIDO!
🧪 MOL E NÚMERO DE AVOGADRO
QUÍMICA Número de Avogadro
Mol (n) (Número de Avogadro y peso molecular)
🧪 MASSA E CONSTANTE DE AVOGADRO
MOL: O SUPER PODER SECRETO DOS CIENTISTAS!!!
Constante de Avogadro [Módulo 09 - Aula 02]
QUIMICA moles y número de AVOGADRO SECUNDARIA (4ºESO)
🌐¿Qué es el Mol? Número de AVOGADRO💫 [Fácil y Rápido] | QUÍMICA |
NÚMERO DE AVOGADRO
MOL, Mol de Moléculas, Mol de Átomos, CONSTANTE de AVOGADRO, Número de Átomos | Aula 13 (Química IV)...
¿Qué es un MOL? Número de AVOGADRO 🫵🏽 Química Básica #estequiometria
O Numero de Avogadro e o Mol
MOL, NÚMERO DE AVOGADRO Y MASA MOLAR | Química Desde Cero
Relación Masa, Mol y Número de Avogadro | Ejemplo 1 y 2
Mol, Massa, Número de Avogadro. Passo a Passo
Mol, massa e massa molar #química #quimica #enem #vestibular #uerj #fuvest
MOL, NÚMERO DE AVOGADRO. GRAMOS. MOLÉCULAS.
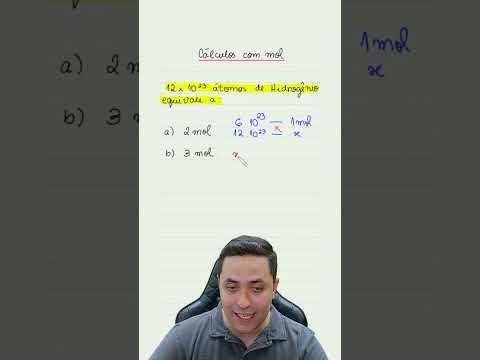
🧪 Cálculo com Mol
O que é mol ou número de Avogadro ? #química #enem #vestibular
QUÍMICA. Pasar de gramos a moles a moléculas y a átomos y al revés
Комментарии
 0:11:22
0:11:22
 0:03:24
0:03:24
 0:04:17
0:04:17
 0:06:37
0:06:37
 0:06:34
0:06:34
 0:05:41
0:05:41
 0:05:04
0:05:04
 0:04:59
0:04:59
 0:40:26
0:40:26
 0:12:48
0:12:48
 0:12:24
0:12:24
 0:01:50
0:01:50
 0:07:01
0:07:01
 0:41:23
0:41:23
 0:03:34
0:03:34
 0:03:20
0:03:20
 0:06:40
0:06:40
 0:07:03
0:07:03
 0:10:31
0:10:31
 0:00:56
0:00:56
 0:09:03
0:09:03
 0:00:49
0:00:49
 0:00:40
0:00:40
 0:13:11
0:13:11