filmov
tv
Fuerza de los ácidos y las bases | 9/22 | UPV

Показать описание
Título: Fuerza de los ácidos y las bases
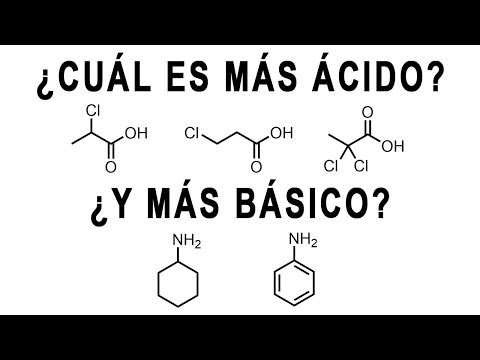
Descripción automática: En este video, se aborda el estudio de la fuerza de los ácidos y bases, apuntando a que los espectadores aprendan a identificar ácidos y bases fuertes y débiles, escribir sus constantes de disociación en agua y clasificarlos por su fuerza relativa. Se utilizan ejemplos cotidianos como el ácido clorhídrico, que es fuerte y se maneja con precaución dada su capacidad corrosiva, y el ácido acético, un ácido débil utilizado en la cocina sin peligro para la ingestión. Analogamente, se cita la sosa cáustica, una base fuerte con aplicaciones en limpieza y fabricación de jabón, que también debe manejarse con cuidado.
Se explica según la teoría de Brönsted y Lowry que un ácido será más fuerte cuanto más tienda a ceder un protón y una base será más fuerte cuanto más tienda a captarlo. La referencia para la fuerza de ácidos y bases es su constante de disociación en agua, con los fuertes estando completamente disociados y los débiles parcialmente, presentando constantes de acidez o basicidad menores. Algunos ejemplos dados incluyen el ácido acético y el amoniaco como ácidos y bases débiles con constantes específicas, mientras que los fuertes, como el ácido clorhídrico o el hidróxido sódico, no tienen valores de constante disponibles por su gran magnitud. Finalmente, se mencionan las constantes de acidez y basicidad (K sub A y K sub B) y sus respectivos valores negativos logarítmicos (pK sub A y pK sub B), útiles para cálculos.
El video concluye enfatizando que si los espectadores son capaces de identificar y clasificar ácidos y bases según lo explicado, los objetivos didácticos se habrán alcanzado, preparándolos para aplicaciones prácticas futuras.
Autor/a: Morera Bertomeu Isabel María
#fuerza #ácidos #bases #fuerza relativa
Descripción automática: En este video, se aborda el estudio de la fuerza de los ácidos y bases, apuntando a que los espectadores aprendan a identificar ácidos y bases fuertes y débiles, escribir sus constantes de disociación en agua y clasificarlos por su fuerza relativa. Se utilizan ejemplos cotidianos como el ácido clorhídrico, que es fuerte y se maneja con precaución dada su capacidad corrosiva, y el ácido acético, un ácido débil utilizado en la cocina sin peligro para la ingestión. Analogamente, se cita la sosa cáustica, una base fuerte con aplicaciones en limpieza y fabricación de jabón, que también debe manejarse con cuidado.
Se explica según la teoría de Brönsted y Lowry que un ácido será más fuerte cuanto más tienda a ceder un protón y una base será más fuerte cuanto más tienda a captarlo. La referencia para la fuerza de ácidos y bases es su constante de disociación en agua, con los fuertes estando completamente disociados y los débiles parcialmente, presentando constantes de acidez o basicidad menores. Algunos ejemplos dados incluyen el ácido acético y el amoniaco como ácidos y bases débiles con constantes específicas, mientras que los fuertes, como el ácido clorhídrico o el hidróxido sódico, no tienen valores de constante disponibles por su gran magnitud. Finalmente, se mencionan las constantes de acidez y basicidad (K sub A y K sub B) y sus respectivos valores negativos logarítmicos (pK sub A y pK sub B), útiles para cálculos.
El video concluye enfatizando que si los espectadores son capaces de identificar y clasificar ácidos y bases según lo explicado, los objetivos didácticos se habrán alcanzado, preparándolos para aplicaciones prácticas futuras.
Autor/a: Morera Bertomeu Isabel María
#fuerza #ácidos #bases #fuerza relativa
 0:08:05
0:08:05
 0:11:29
0:11:29
 0:23:34
0:23:34
 0:11:05
0:11:05
 0:04:00
0:04:00
 0:07:54
0:07:54
 0:09:43
0:09:43
 0:24:32
0:24:32
 0:05:09
0:05:09
 0:01:41
0:01:41
 0:01:03
0:01:03
 0:06:48
0:06:48
 0:14:52
0:14:52
 0:07:09
0:07:09
 0:10:39
0:10:39
 0:11:35
0:11:35
 0:04:17
0:04:17
 0:14:30
0:14:30
 0:13:58
0:13:58
 0:15:31
0:15:31
 0:03:57
0:03:57
 0:14:09
0:14:09
 0:15:37
0:15:37
 0:03:47
0:03:47