filmov
tv
Calcul du spectre de l'atome d'hydrogène

Показать описание
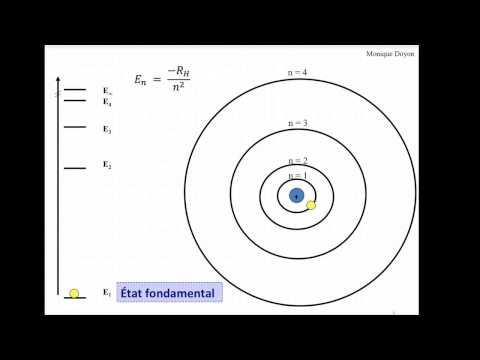
Le spectre de l'atome d'hydrogène et comment calculer les longueurs d’onde d'onde des raies des séries de Lyman, Balmer et Paschen. Après un rappel sur l’atome d’hydrogène de Bohr, ses états, son diagramme d’énergie avec le calcul des niveaux d’énergies de n=1 à n=4; le cours emboîte le pas sur les formules littérales Δe=hv=hc/λ, afin d’en déduire λ=hc/Δe. Lors de nombreux calculs de longueurs d’onde, il est plus commode d’utiliser la formule semi littérale λ(nm) = 1243/ Δe(ev). C’est ainsi que dans ce cours, je montre par l’exemple, le calcul de trois longueurs d’onde dans les spectre de l'atome d'hydrogène, et plus précisément : Une raie calculée de 122 nm dans la série de Lyman correspondante au saut quantique de n2 à n1, une autre raie rouge de 658 nm calculée dans la série de Balmer correspondante au saut quantique de n3 à n2 et enfin une dernière raie de 1883 nm calculée dans la série de Paschen correspondante au saut quantique de n4 à n3.
Ce cours de soutien scolaire constitue un bon support de révision pour les lycéens en terminale en vue du bac, mais aussi pour la première année de santé, médecine, chimie, paces, …
En fin de chaque vidéo, vous pouvez retrouvez de nombreux cours dans les playlists proposées afin de compléter vos connaissances.
Ce cours de soutien scolaire constitue un bon support de révision pour les lycéens en terminale en vue du bac, mais aussi pour la première année de santé, médecine, chimie, paces, …
En fin de chaque vidéo, vous pouvez retrouvez de nombreux cours dans les playlists proposées afin de compléter vos connaissances.
Комментарии
 0:04:51
0:04:51
 0:11:30
0:11:30
 0:02:11
0:02:11
 0:29:00
0:29:00
 0:04:35
0:04:35
 0:04:34
0:04:34
 0:02:21
0:02:21
![[RévisionsBac.com] - Niveaux](https://i.ytimg.com/vi/iuQKOQIsNGQ/hqdefault.jpg) 0:02:55
0:02:55
 0:00:59
0:00:59
 0:19:43
0:19:43
 0:12:47
0:12:47
 0:01:00
0:01:00
 0:39:27
0:39:27
 0:04:39
0:04:39
 0:29:59
0:29:59
 0:04:50
0:04:50
 0:02:00
0:02:00
 0:15:33
0:15:33
 0:09:32
0:09:32
 0:15:12
0:15:12
 0:25:48
0:25:48
 0:02:52
0:02:52
 0:04:47
0:04:47
 0:04:38
0:04:38