filmov
tv
Lezioni di chimica - legame chimico - 11 (teoria dell' Orbitale Molecolare- introduzione- parte 1)

Показать описание
Per donazioni:
Sto scrivendo degli ebook. Li trovi su
e su tanti altri store.
Sto scrivendo degli ebook. Li trovi su
e su tanti altri store.
Legame Ionico - Legami Chimici | Lezioni di Chimica
Legame Metallico - Legami Chimici | Lezioni di Chimica
Legame covalente: puro, multiplo e dativo - Legami Chimici | Lezioni di Chimica
Lezione di Chimica Base - Il Legame Chimico
Lezioni di chimica - Legame chimico - 1 (tipi di legame chimico, legame covalente)
Com'è fatto l'ATOMO? Cosa sono gli IONI e gli ISOTOPI? | Lezioni di Chimica
Legame Covalente Polare - Legami Chimici | Lezioni di Chimica
Lezioni di chimica - legame chimico - 2 (energia della molecola di idrogeno, teoria VB)
Lezioni di chimica - legame chimico - 9 (risonanza- parte 1)
LA TEORIA DEI LEGAMI DI VALENZA
Ibridazione del carbonio - I composti del carbonio
La Tavola periodica degli elementi | Lezioni di Chimica
Esercizi base sul Legame Covalente | Lezioni di Chimica
Legame Covalente in 2 minuti - Chimica - in10minuti
corso di chimica: legame chimico, ionico e covalente
Lezioni di chimica - legame chimico - 11 (teoria dell' Orbitale Molecolare- introduzione- parte...
Atomo di Carbonio - Configurazione elettronica e ibridazione | Chimica Organica
LA CHIMICA FACILE - Lezione 04 - I legami chimici
Introduzione al legame chimico - Lezione 9 - Chimica per i test d'ingresso!
Legame a Idrogeno - Legami Intermolecolari | Lezioni di Chimica
Lezioni di chimica - legame chimico - 15 (legame dipolare, legame idrogeno)
Lezioni di chimica - legame chimico - 5 (legame di coordinazione, ibridazione del carbonio, VSEPR)
Lezioni di chimica - Legame chimico - 16 (legame metallico, metalli)
Lezioni di chimica - legame chimico - 17 (semiconduttori)
Комментарии
 0:11:39
0:11:39
 0:09:42
0:09:42
 0:19:33
0:19:33
 0:18:10
0:18:10
 0:13:02
0:13:02
 0:15:26
0:15:26
 0:11:19
0:11:19
 0:11:50
0:11:50
 0:14:23
0:14:23
 0:09:09
0:09:09
 0:01:23
0:01:23
 0:20:49
0:20:49
 0:12:22
0:12:22
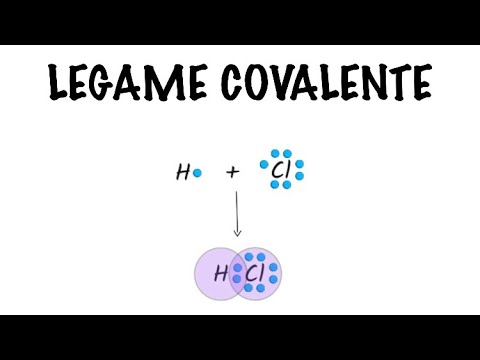 0:01:53
0:01:53
 0:17:44
0:17:44
 0:12:07
0:12:07
 0:09:09
0:09:09
 0:48:24
0:48:24
 0:15:06
0:15:06
 0:17:18
0:17:18
 0:10:43
0:10:43
 0:12:35
0:12:35
 0:13:04
0:13:04
 0:09:26
0:09:26